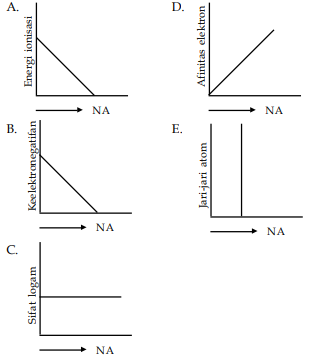
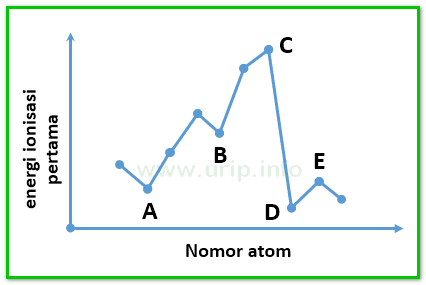
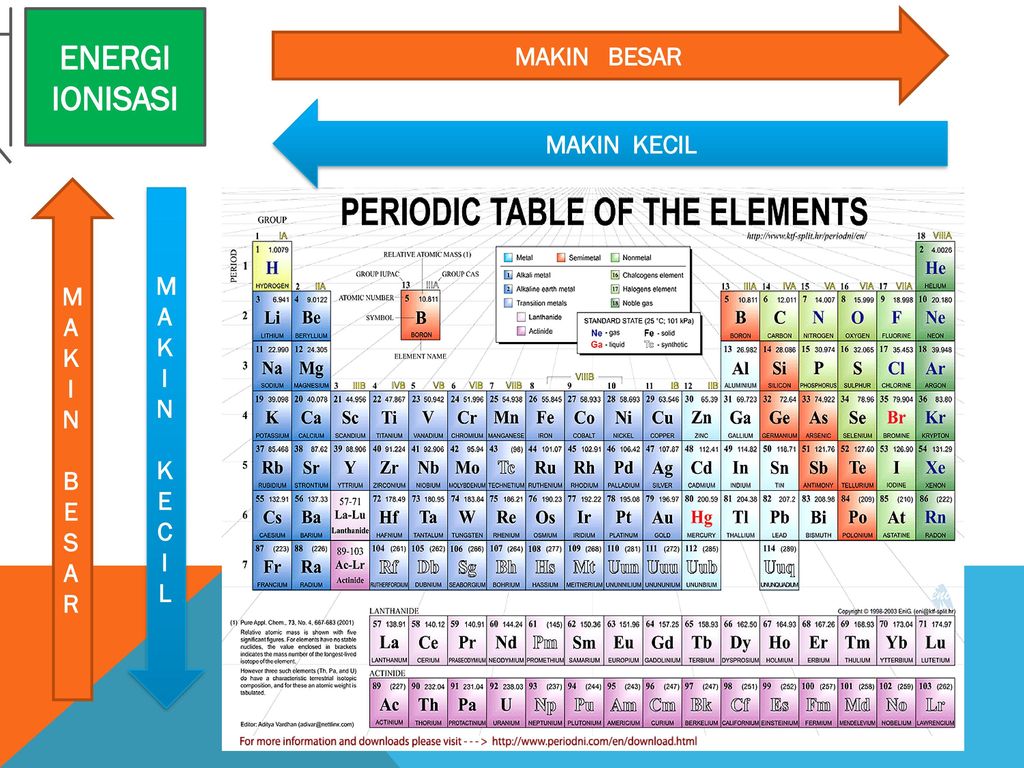
Energi untuk mengeluarkan satu elektron pertama dari atom netralnya disebut sebagai energi ionisasi pertama dan untuk mengeluarkan satu elektron ke dua disebut energi ionisasi kedua dan begitu seterusnya untuk pengeluaran satu elektron berikutnya. Contoh soal menentukan kecenderungan energi ionisasi.
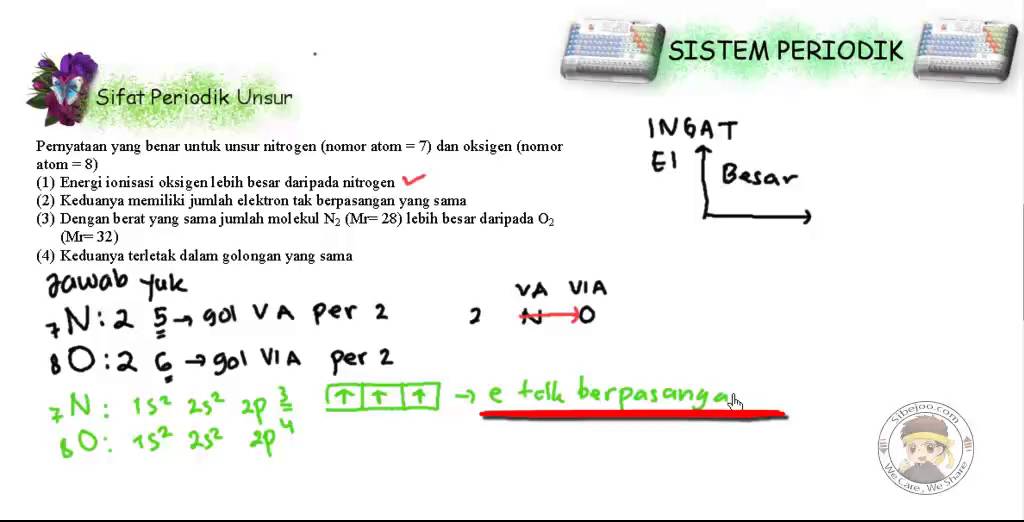
Sistem Periodik Contoh Soal Sifat Periodik Unsur 2
Contoh soal energi ionisasi. Jadi energi ionisasi mg lebih besar dari na. Contoh dari energi ionisasi unsur dalam elektron volt ev nitrogen 1453. Ion yang bermuatan positif diperoleh saat elektron yang terikat pada molekul atau atom menyerap engergi cukup agar. Energi ionisasi e i adalah energi yang diperlukan untuk mengeluarkan elektron dari tiap mol spesies dalam keadaan gasenergi untuk mengeluarkan satu elektron pertama dari atom netralnya disebut sebagai energi ionisasi pertama dan untuk mengeluarkan satu elektron ke dua disebut energi ionisasi kedua dan begitu seterusnya untuk pengeluaran satu elektron berikutnya. Golongan alkali dalam sistem periodik unsur menempati posisi paling sebelah kiri golongan 1a. Demikian pula energi ionisasi ca lebih besar dari k.
Pembahasan soal nomor 3. Energi ionisasi pengertian penjelasan contoh soal dan pembahasan unsur unsur yang terdapat dalam satu golongan dalam tabel priodik unsur energi ionisasinya makin ke bawah semakin kecil. Proses ionisasi kemuatan negatif atau positif sedikit berbeda. Energi yang didapatkan oleh atom ini bisa berasal dari berbagai sumber energi seperti energi listrik panas dan lain sebagainya. Sifat keperiodikan energi ionisasi energi ionisasi adalah energi yang diperlukan suatu atom untuk melepaskan satu elektron valensi membentuk ion positif. Pengertian ionisasi disosiasi dan eksitasi beserta contohnya ionisasi merupakan suatu proses mengubah molekul atau atom menjadi ion dengan mengurangi atau menambah partikel bermuatan seperti elektron adat lainnya.
Energi ionisasi juga dikenal sebagai potensial ionisasi adalah energi yang diperlukan oleh suatu atom untuk melepas elektron yang ada pada atom netral di dalam keadaan gas. Elektron terluar semakin jauh jaraknya dari inti. Perhatikanlah gambar 110 dalam satu golongan dari atas ke bawah jumlah kulit bertambah sehingga jarak elektron valensi ke inti atom bertambah dan elektron lebih mudah lepas. Unsur unsur golongan alkali akan memiliki energi ionisasi pertama paling rendah dibanding unsur seperiode karena jari jari atom yang relatif lebih besar sehingga untuk melepaskan elektron pada kulit terluarnya relatif lebih mudah dibutuhkan energi yang lebih rendah pula. Dalam golongan yang sama dari atas ke bawah energi ionisasi berkurang akibat orbit elektron makin jauh dari inti.